






《无机化学p区元素一PPT课件电子版》是由用户上传到老师板报网,本为文库资料,大小为18.93 MB,总共有87页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 87页
- 18.93 MB
- VIP模板
- ppt
- 数字产品不支持退货
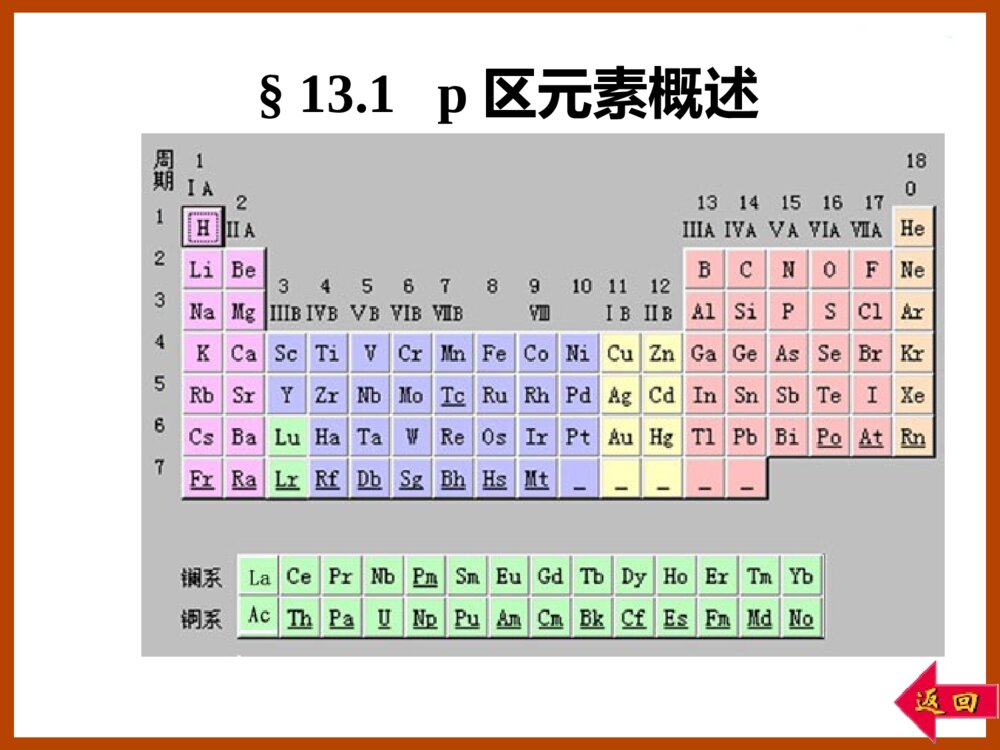
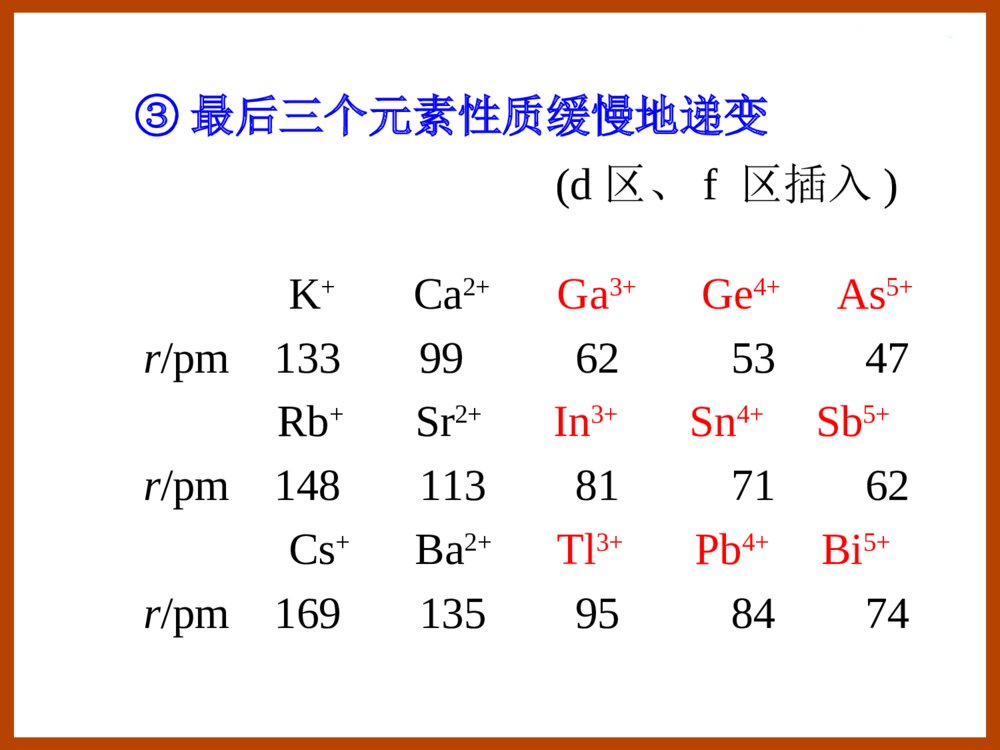
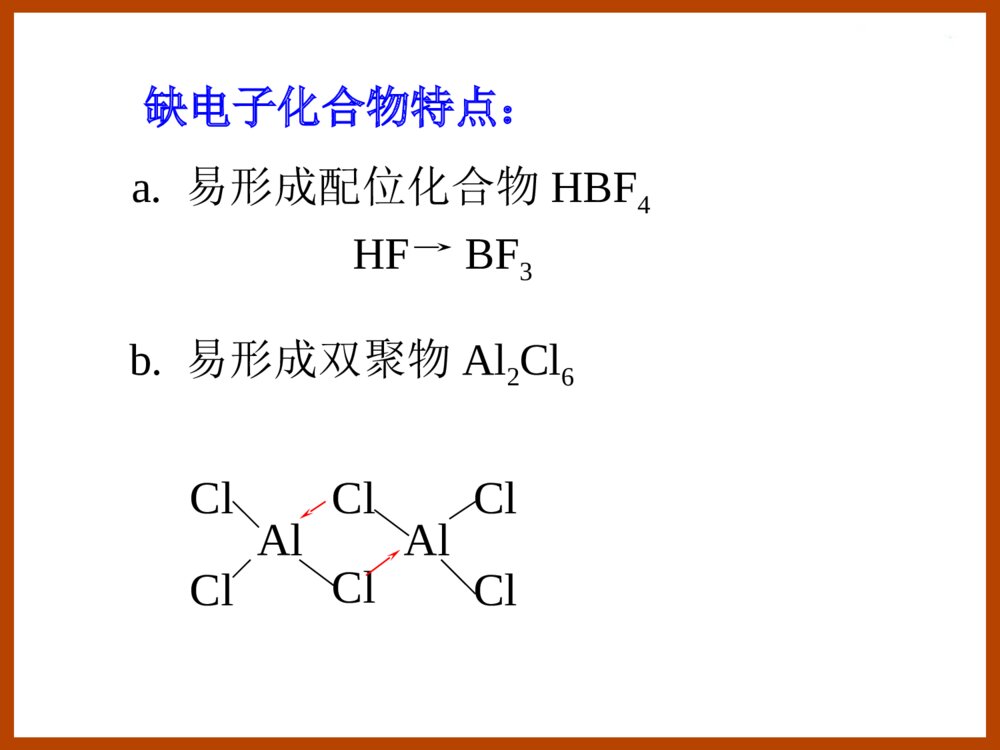
第十三章p区元素(一)§13.3碳族元素§13.2硼族元素§13.1p区元素概述§13.1p区元素概述①第二周期元素具有反常性(只有2s,2p轨道)形成配合物时,配位数最多不超过4;第二周期元素单键键能小于第三周期元素单键键能(kJ/mol-1)E(N-N)=159E(O-O)=142E(F-F)=141E(P-P)=209E(S-S)=264E(Cl-Cl)=199p区元素性质的特征•各族元素性质由上到下呈现二次周期性②第四周期元素表现出异样性(d区插入)EV458.1)/ClClO(23V513.1)/BrBrO(23EV209.1)/IIO(23EV226.1)/ClOClO(34E例如:溴酸、高溴酸氧化性分别比其他卤酸(HClO3,HIO3)、高卤酸(HClO4,H5IO6)强。EV60.1)/IOIOH(365EV763.1)/BrOBrO(34③最后三个元素性质缓慢地递变K+Ca2+Ga3+Ge4+As5+r/pm13399625347Rb+Sr2+In3+Sn4+Sb5+r/pm148113817162Cs+Ba2+Tl3+Pb4+Bi5+r/pm169135958474(d区、f区插入)价电子构型:ns2np1-5例如:氯的氧化值有+1,+3,+5,+7,-1,0等。惰性电子对效应:同族元素从上到下,低氧化值化合物比高氧化值化合物变得更稳定。•多种氧化值例如:Si(II)Pb(IV)价电子结构分别为[Xe]6s2,[Xe]•电负性大,形成共价化合物§13.2硼族元素13.2.4铝的化合物13.2.3硼的化合物13.2.2硼族元素的单质13.2.1硼族元素概述13.2.1硼族元素概述硼族(ⅢA):B,Al,Ga,In,Tl价电子构型:ns2np1缺电子元素:价电子数<价层轨道数缺电子化合物:成键电子对数<价层轨道数例如:BF3,H3BO3。注意:HBF4不是缺电子化合物。ClClAlClClClClAl缺电子化合物特点:b.易形成双聚物Al2Cl6HFBF3a.易形成配位化合物HBF4硼族元素的一般性质•B为非金属单质,Al,Ga,In,Tl是金属•氧化态:B,Al,Ga:(+3)In:(+1,+3)Tl:(+1)“惰性电子对效应”•最大配位数:B:4例:HBF4其它:6例:Na3AlF6硼族元素标准电极电势图如下:13.2.2硼族元素的单质硼的单质同素异形体:无定形硼,晶形硼棕色粉末,黑灰色化学活性高,硬度大熔点,沸点都很高。α-菱形硼(B12)原子晶体硼正二十面体α-菱形硼(B12)层状结构的原子晶体13.2.3硼的化合物1.硼的氢化物硼烷分类:BnHn+4和BnHn+6例:B2H6B4H10乙硼烷丁硼烷有CH4,但无BH3最简单的硼烷:B2H6其结构并非如右图所示:HHBBHHHH•硼烷的结构B利用sp3杂化轨道,与氢形成三中心两电子键。(氢桥)记作:HHBBHHHH要点:B的杂化方式,三中心两电子键、氢桥。111100B4H10分子结构•硼烷的性质①自燃高能燃料,剧毒②水解含硼化合物燃烧火焰呈现绿色O(g)3H(s)OB(g)3O(g)HB232262(g)H6(s)BO2HO(l)3H(g)HB233262水下火箭燃料molkJ-509.3-1rHm¡÷rHm¡÷-1molkJ-2034③加合反应CO]B2[HCOHB362④被氯氯化6HCl(l)2BCl(g)6Cl(g)HB3262-1molkJ-1376rHm¡÷4622NaBHHB2NaH4622LiBHHB2LiH][BH])(NH[BH2NHHB4232362①三氧化二硼B2O3B(无定形)B2O3H3BO3O2Mg或Al+H2O-H2O制备:O3HOBBO2H(s)O2B(g)3O4B(s)23233322原子晶体:熔点460C无定形体:软化2.硼的含氧化合物结构:性质:3MgO2B3MgOB32偏硼酸(原)硼酸xB2O3·yH2O多硼酸B2O32HBO22H3BO3+H2O+H2O-H2O-H2OB:sp2杂化OHBOOHH②硼酸H3BO3结构:性质:•一元弱酸(固体酸)•与多羟基化合物加合-OCHOCHRR\'BHCOHCORR\'O3HH2OHCH2BOH33OHCHRR\'HOCHHOCHRR\'HOHOBOHHCOHHCOHRR\'•受热易分解)(OBHBOBOH32O-H2O-H3322玻璃态OHBOH233HB(OH)-4K=5.8×10-10③硼砂O10HOBNa2742O8H(OH)OBNa24542硼酸根的结构:O性质:构成缓冲溶液pH=9.24(20℃)•水解呈碱性•与酸反应制H3BO34233242742SONaBOH4O5HSOHOBNaO5H](OH)OB[22454-332OHBO4H-4332B(OH)BO2H-332OHBO4H•脱水O10H2NaBOOBOH10OBNa22328782742℃硼砂珠实验:)(2NaBO)Co(BOCoOOBNa222742蓝色)(2NaBO)Ni(BONiOOBNa222742棕色3.硼的卤化物•BX3结构:B:sp2杂化•BX3性质:BXXXBF3BCl3BBr3BI3室温下聚集态ggls熔点/℃-127.1-107-4649.9沸点/℃-100.412.791.321064水解:I)Br,Cl,(X3HXBOHO3HBX332333BFHFHFBF]3H[BFBOHO3H4BF43323氟硼酸为强酸4.硼的氮化物BN与C2是等电子体,结构相似,性质相似:BN有三种晶型:•无定形(类似于无定型碳)•六方晶型(类似于石墨)作润滑剂•立方晶型(类似于金刚石)作磨料、坩埚材料1.氧化铝和氢氧化铝氧化铝:Al2O3α-Al2O3:刚玉,硬度大,不溶于水、酸、碱。γ-Al2O3:活性氧化铝,可溶于酸、碱,可作为催化剂载体。13.2.4铝的化合物红宝石(Cr3+)蓝宝石(Fe3+,Ti4+)黄玉/黄晶(Fe3+)有些氧化铝晶体透明,因含有杂质而呈现鲜明颜色。在碱性溶液中存在[Al(OH)4]-或[Al(OH)6]3-简便书写为332AlOAlO或氢氧化铝:Al(OH)3两性:Al(OH)3+3H+Al3++3H2OAl(OH)3+OH-[Al(OH)4]-2.铝的卤化物离子晶体分子晶体分子晶体:熔点低,易挥发,易溶于有机溶剂,易形成双聚物。水解激烈:HCl3Al(OH)O3HAlCl323AlF3AlCl3AlBr3AlI3离子键共价键用干法合成AlCl3:322AlCl(g)3ClAl2潮湿空气中的AlCl3,遇NH3生成NH4Cl。白烟为NH4ClCO32AlCl3Cl3COAl3232(g)3H2AlCl6HCl(g)2Al233.铝的含氧酸盐硫酸铝:342)(SOAlOH12)KAl(SO224S(g)3H(s)2Al(OH)O6H2S2Al232-23Al3+易水解:K=10-5.03(g)3CO(s)2Al(OH)OH3CO32Al232-233[Al(H2O)6]3+[Al(OH)(H2O)5]2++H+铝钾矾(明矾):类质同晶现象Al3+的鉴定:在氨碱性条件下,加入茜素O3H)()OHAl(C234714红色茜素3NH(s)Al(OH)OH3NHAl43233(OH)OHC3Al(OH)226143§13.3碳族元素13.3.5锡、铅的化合物13.3.4硅的化合物13.3.3碳的化合物13.3.2碳族元素的单质13.3.1碳族元素概述13.3.1碳族元素概述价电子构型:ns2np2CSiGeSnPb-4+2+4(+2)+2+2+4+4+4(+4)46666氧化值最大配位数单质可形成原子晶体金属晶体碳族(IVA):6C14Si32Ge50Sn82Pb碳硅锗锡铅价层电子构型ns2np2,这些元素原子被称为等电子原子。最高氧化态为+4。在锗、锡、铅中,随着原子序数的增大,稳定氧化态逐渐由+4变为+2(惰性电子对效应)。碳和硅都有自成键的特性,碳的自相结合成链的能力更强。除C—C单键外,碳原子间还存在双键和叁键,而硅原子形成重键的倾向弱。碳族元素的标准电极电势图存在形式:碳:金刚石、石墨;煤、石油、天然气;碳酸盐;CO2。硅:SiO2和各种硅酸盐。锗:硫银锗矿4Ag2S•GeS2,硫铅锗矿2PbS•GeS2。锡:锡石SnO2。铅:方铅矿PbS,白铅矿PbCO3。锡石SnO2方铅矿PbS13.3.2碳族元素的单质碳单质的同素异形体:金刚石:原子晶体,硬度最大,熔点最高。石墨:层状晶体,质软,有金属光泽。足球烯或富勒烯:C60,C70等。C60是1985年用激光轰击石墨作碳的气化实验时发现的。C60是由12个五边形和20个六边形组成的32面体。碳纤维石墨(sp2杂化)金刚石(sp3杂化)富勒烯C60柯尔克罗托斯莫利富勒烯于1985年被发现,这三位科学家荣获1996年诺贝尔化学奖。分子晶体单壁碳纳米管多壁碳纳米管•1991年,日本电子显微镜专家Iijima发现了多壁碳纳米管,直径为4-30nm,长度为1μm。•1993年单壁碳纳米管也被发现,直径从0.4nm到3-4nm,长度可达几微米。碳纳米管(Carbonnanotubes)石墨烯(Graphene)厚度只有0.335nm透明胶带成就的诺贝尔奖(2010年)安德烈·海姆康斯坦丁·诺沃肖洛夫2004年被分离出来硅单质有无定形体和晶体两种,其晶体类似金刚石。锗单质是灰白色金属,硬而脆,结构类似于金刚石。锡单质有三种同素异形体:铅单质:质软,能阻挡X射线。可作电缆的包皮,核反应堆的防护屏。13.2℃161℃灰锡(α锡)白锡(β锡)脆锡13.3.3碳的化合物结构:CO(6+8=14e-)与N2(2×7=14e-)是等电子体,结构相似。一个σ键两个π键:CO:1.碳的氧化物(1)一氧化碳(CO):CO:性质:①作配位体,形成羰基配合物Fe(CO)5,Ni(CO)4,Co2(CO)8其中C是配位原子。②还原剂:(g)CO(g)O21CO(g)22(g)3CO2Fe(s)3CO(g)(s)OFe232③剧毒(2)二氧化碳(CO2)43Π:OCO:经典的分子结构:O=C=OOC=O双键键长124pm(在CH3--C--CH3中)CO叁键键长113pmCO2中,碳、氧之间键长116pmC:sp杂化固体二氧化碳干冰OOCσσ43Π43Π这些原子(3个或3个以上)在同一平面上。每一个原子有一个相互平行的p轨道。p电子数目必须小于p轨道数目的2倍。离域π键形成条件离域π键由三个或三个以上原子形成的多中心大π键。ab符号:a代表电子数b代表成键原子数2.碳酸及其盐CO2溶于水,大部分CO2•H2O,极小部分H2CO3CO32-的结构:CO32-(6+3×8+2=32e-)与BF3(5+3×9=32e-)为等电子体。C:sp2杂化COOO2-64Π-71-332104.4HCOHCOHK11-2-23-3104.7COHHCOK碳酸及其盐的热稳定性:①H2CO3



















